Autor: Peter Pančík
Publikované dňa:
Citácia: PANČÍK, Peter. 2016. Biopedia.sk: Izolácia nukleových kyselín. [cit. 2024-04-19]. Dostupné na internete: <https://biopedia.sk/molekularna-biologia/izolacia-nukleovych-kyselin>.
Izolácia nukleových kyselín je prvým krokom v mnohých experimentoch molekulárnej biológie. Ideálne je potrebné získať cieľovú nukleovú kyselinu (DNA alebo RNA) v dostatočnom množstve a kvalite, to je bez prímesí "zbytočných" látok, tzv. kontaminantov. Vo všeobecnosti sa ťažšie izolujú nukleové kyseliny z rastlinných buniek kvôli prítomnosti kompaktnej celulózovej bunkovej stene a chemických zlúčenín obsiahnutých vo vakuolárnej šťave.
Výber metódy izolácie záleží od spôsobu, akým sa bude nukleová kyselina v ďalšom postupe analyzovať. Napr. pri použití metódy PCR (polymerázová reťazová reakcia) postačujú malé množstvá DNA, ktorej čistota a integrita nie sú vo väčšine prípadov kritické. Na druhej strane, pri klonovaní, enzymatickom opracovaní DNA restrikčnými endonukleázami alebo pri sekvenovaní sú potrebné relatívne väčšie množstvá DNA s vyššou čistotou. Rovnako pri kvalitatívnej a kvantitatívnej analýze génovej expresie je potrebné väčšie množstvo mRNA, ktorej integrita je kritická pre výsledok ďalších molekulárno-biologických analýz.
Izoláciu nukleových kyselín je možné rozdeliť na dva základné kroky, ktorými sú:
- lýza buniek
- purifikácia nukleových kyselín od kontaminujúcich zložiek bunkového obsahu
Lýza buniek a tkanív link
Nukleové kyseliny je možné izolovať z rôznych zdrojov. V prípade, že sa bunková kultúra pestuje v tekutom médiu, je prvým krokom izolácie oddelenie buniek od média centrifugáciou. Aby došlo k uvoľneniu nukleovej kyseliny do vodného roztoku, je potrebné rozrušiť (dezintegrovať) bunkové steny a biomembrány. Iné postupy si vyžaduje izolácia z bakteriálnych buniek, iné z rastlinných buniek a najjednoduchšie sa izolujú nukleové kyseliny zo živočíšnych tkanív a bunkových kulúr.
Lýza bakteriálnych buniek link
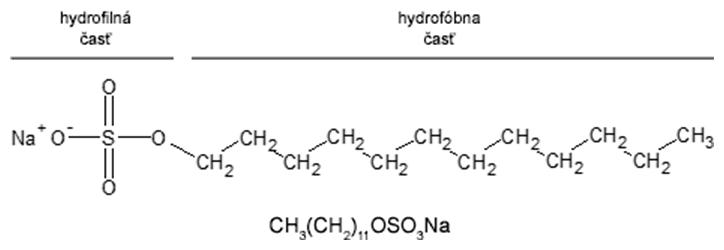
V prípade niektorých baktérií, ktoré majú veľmi hrubú bunkovú stenu alebo tvoria veľa sekundárnych metabolitov, je výhodné izolovať DNA z buniek v logaritmickej fáze rastu, t.j. pri ich aktívnom hromadnom delení. Na lýzu bakteriálnych buniek sa najčastejšie používa enzymatické opracovanie bunkovej steny lyzozýmom, ktorý hydrolyzuje glykozidické väzby v peptidoglykánoch. Tento enzým sa prirodzene vyskytuje vo vaječnom bielku (zdroj na izoláciu) a v slzách. Druhým krokom je rozrušenie cytoplazmatickej membrány bakteriálnej bunky pôsobením ionogénnych detergentov (detergentov tvoriacich ióny), napr. SDS - dodecylsulfát sodný. Nevzácne je treba okrem chemickej lýzy použiť aj mechanickú lýzu bakteriálnych buniek pomocou ultrasonikátora, ktorý na disrupciu buniek využíva ultrazvukové vlny. Treba však mať na pamäti, že prehnaná ultrasonikácia vedie k rozbitiu nielen samotných buniek ale aj vysokomolekulovej DNA bakteriálneho chromozómu.
Lýza rastlinných buniek link
Na uvoľnenie obsahu rastlinných buniek obalených bunkovou stenou sa používa v prvom kroku mechanické ako aj enzymatické opracovanie (celulázy). Niekedy však postačuje aj tekutý dusík, ktorý bunkové steny spoľahlivo rozbije a prípadné DNázy a RNázy udrží za nízkej teploty inaktívne.
Lýza živočíšnych buniek link
V prípade izolácie nukleových kyselín zo živočíšnych tkanív a celých orgánov (myšacia slezina, pečeň, mozog) je potrebná homogenizácia vstupného materiálu. K tomuto účelu je možné použiť mechanické rozdrvenie v homogenizátore alebo rozrušenie bunkovej hmoty zmrazením v tekutom dusíku. Živočíšne bunky sú obalené len cytoplazmatickou membránou, a preto je možné dosiahnuť ich lýzu jemnejšími prostriedkami, napr. pôsobením slabých neionogénnych detergentov (napr. Triton X-100) v kombinácii s proteolytickými enzýmami (napr. proteináza K).
Ostatné zdroje link
DNA môže byť izolovaná aj z extrémnych zdrojov ako je pôda, úžitková voda, potraviny a iné. Pri izolácii je potrebné použiť pokiaľ možno materiál čerstvý alebo čerstvo zmrazený, aby sa zabránilo možnej degradácii nukleových kyselín prítomnými nukleázami (DNáza, RNáza).
Chelatačné činidlá link
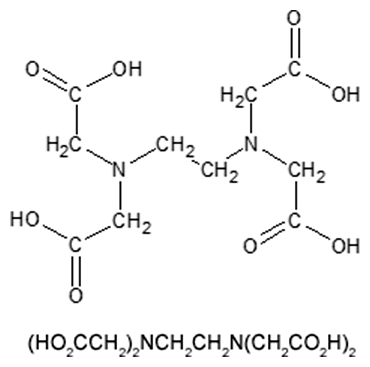
K rozpadu bunkových štruktúr prispieva degradácia proteínov pomocou enzýmov proteáz, napr. proteinázy K. Dôležitým faktorom je aj prítomnosť chelatačných činidiel (napr. EDTA - kyselina etyléndiamíntetraoctová), ktoré z roztoku "vychytávajú" dvojmocné katióny (Mg2+, Ca2+), čím inaktivujú bunkové DNázy. Neprítomnosť dvojmocných katiónov zároveň destabilizuje vonkajšiu bakteriálnu membránu.
Zloženie tlmivého roztoku pri izolácii DNA:
1x TE
10 mmol.l-1 Tris-HCl (pH = 7,5)
1 mmol.l-1 EDTA
Centrifugácia v hustotnom gradiente link
Zdrojom nukleových kyselín môžu byť aj subcelulárne častice - organely alebo vírusy, ktoré získame po izolácii centrifugáciou v hustotnom gradiente. Ten pozostáva zo starostlivo namiešaného roztoku (najčastejšie sacharózy) s najväčšou koncentráciou naspodu, na ktorý postupne nalievame roztoky s nižšou koncentráciou, pričom pri pozornej príprave sa tieto roztoky nezmiešajú ale ostanú ako oddelené fázy. Pri centrifugácii bunkového materiálu v takomto hustotnom gradiente dochádza k zachytávaniu rôzne ťažkých sedimentov na určitom medzistupni/fáze. Ťažký bunkový materiál klesne na dno, organely sa zachytia vo vyšších vrstvách, pretože im ich hmotnosť nedovolí prejsť cez hustejší a ťažší sacharózový roztok.
Purifikácia nukleových kyselín link
Princípom purifikácie akéhokoľvek materiálu z buniek je cieľom zbaviť sa zložiek, ktoré pri ďalšej práci nepotrebujeme. Pri izolácii nukleových kyselín je dôležité odstrániť zo zmesi proteíny, medzi ktoré patria aj bunkové nukleázy, ktoré môžu degradovať izolovanú nukleovú kyselinu, ako aj proteíny viažúce sa na DNA, ktoré svojou prítomnosťou môžu rušiť následné analýzy (napr. štiepenie restrikčnými endonukleázami). Na odstránenie proteínov sa používajú nešpecifické proteázy, najčastejšie proteináza K.
Na odstránenie RNA z preparátov DNA sa používa pankreatická RNáza. Tento enzým je veľmi stabilný a zároveň nevyžaduje pre svoju aktivitu dvojmocné ióny, čo neplatí napr. pre DNázy. Pri izolácii RNA je zas dôležitým krokom odstránenie prímesí genomickej DNA, čo zabezpečí pankreatická DNáza. V tomto prípade je potrebné použiť komerčne dostupné DNázy, ktoré neobsahujú stopy RNáz.
Fenolová extrakcia link
Na odstránenie proteínov z preparátov nukleových kyselín sa často používa extrakcia organickými rozpúšťadlami (fenol, chloroform = trichlórmetán). Tieto látky sú s vodou nemiešateľné, a preto sa po ich pridaní k vodnému roztoku nukleových kyselín vytvoria dve fázy. Pri premiešaní takejto zmesi dochádza na fázovom rozhraní k denaturácii proteínov. Zrazeninu denaturovaných proteínov je možné odstrániť centrifugáciou, počas ktorej zrazenina vytvorí prstenec na rozhraní medzi spodnou (organickou, chloroformovou/fenolovou) a hornou (vodnou) fázou.
Po fenolovej extrakcii je dôležité zbaviť roztoky nukleových kyselín zvyškov fenolu, pretože fenol môže inhibovať následné enzymatické reakcie (napr. restrikčné štiepenie). K tomuto účelu sa používa extrakcia zmesou chloroform:izopropylalkohol a zrážanie nukleových kyselín alkoholom (etanolom alebo izopropanolom).
Zrážanie nukleových kyselín alkoholom link
Na prečistenie nukleových kyselín od nízkomolekulových látok (soli, zvyšky fenolu) a na skoncentrovanie vzorky sa používa alkoholové zrážanie (najčastejšie čistým, bezvodým etanolom alebo izopropanolom). Zrážanie sa robí v prítomnosti jednomocných iónov (napr. 0,1 M octan sodný) a pri nízkej teplote (-20°C). V týchto podmienkach je výťažok kvantitatívny aj pri nízkej koncentrácii DNA. Na druhej strane, zrážanie pri laboratórnej teplote (+20°C) je výhodné, ak chceme vyzrážať DNA bez súčasného vyzrážania ("oživenia") kontaminujúcej RNA. Vyzrážaná nukleová kyselina sa nazýva precipitát.
Precipitát DNA sa od roztoku oddelí vysokootáčkovou centrifugáciou. Premytím 70% etanolom sa odstránia zvyšky solí prítomné v precipitáte a precipitát sa vysuší tak, aby sa odparili zvyšky etanolu, ale zároveň aby DNA zostala hydratovaná. Molekula DNA v kyslom prostredí môže spontánne degradovať, a preto sa DNA rozpúšťa v slabo zásaditom tlmivom roztoku s prídavkom EDTA (tzv. roztok TE). Roztoky nukleových kyselín sa skladujú pri teplote 4°C, dlhodobejšie pri -20°C.
Podobný postup precipitácie možno použiť aj v prípade RNA, ale vhodnejšie je výsledný precipitát rozpustiť v čistej vode namiesto roztoku TE a roztok RNA sa zásadne uskladňuje pri nižších teplotách (-80°C).
Alkalická lýza - izolácia plazmidovej DNA link
Táto metóda sa používa pri izolácii plazmidov z bakteriálnych buniek za súčasného odstránenia chromozomálnej DNA. Bakteriálne bunky sú lyzované v alkalickom prostredí (0,2 M NaOH) v prítomnosti detergentu (1% SDS). Chromozomálna DNA je pri lýze fragmentovaná na lineárne molekuly, zatiaľ čo plazmidová DNA, ktorá má podstatne menšiu veľkosť, si zachová cirkulárnu formu. Pri pH okolo 12, ktoré je v roztoku, dochádza k denaturácii DNA, t.j. vodíkové väzby medzi bázami sa uvoľnia a vznikajú jednovláknové molekuly. Po neutralizácii roztoku (octanom draselným) kruhová plazmidová DNA renaturuje do pôvodnej dvojvláknovej formy, ale lineárne molekuly chromozomálnej DNA nie sú schopné tak rýchlo renaturovať, a preto agregujú s inými zložkami lyzátu (bunkové steny a membrány, proteíny, SDS). Táto zrazenina sa odstráni z roztoku centrifugáciou, čím sa získa plazmidový preparát, ktorý je možné priamo použiť v ďalších experimentoch.
Ultracentrifugácia v gradiente CsCl link
DNA môže byť purifikovaná zo zmesi makromolekúl ultracentrifugáciou za pomoci chloridu cézneho (CsCl) a etídium bromidu. DNA sa skoncentruje do úzkeho prúžku v strede gradiendu, pričom lineárna a cirkulárna (plazmidová) DNA majú inú hustotu, a preto je možné ich touto metódou navzájom oddeliť. Po centrifugácii sa vyberú frakcie obsahujúce DNA, etídium bromid sa odstráni extrakciou n-butanolom a DNA sa z roztoku získa etanolovou precipitáciou. Výsledkom tejto techniky je vysokomolekulárna DNA s vysokou čistotou. Zároveň je však gradientová centrifugácia veľmi prácna, časovo náročná a relatívne drahá, a preto sa v súčasnosti používa zriedkavo.
Izolácia RNA link
Pri izolácii RNA z akéhokoľvek biologického materiálu je hlavným problémom jej nestabilita. Molekula RNA podlieha degradácii oveľa ľahšie ako DNA a zároveň ribonukleázy sú vo všeobecnosti veľmi stabilné a všadeprítomné enzýmy, ktoré nepotrebujú k svojej aktivite ako kofaktory dvojmocné ióny, na rozdiel od DNáz. Preto je potrebné pri izolácii dodržiavať absolútnu čistotu laboratórnych pomôcok, používať sterilné "RNáza-free" roztoky a spotrebný materiál a pracovať v rukaviciach.
Na zabránenie degradácie sa do roztokov s RNA pridávajú inhibítory RNáz, ktorými sú napr.:
- RNasin (RNázový proteínový inhibítor z ľudskej placenty)
- vanadyl-ribonukleozidový komplex
- guanidin-hydrochlorid (GuHCl)
- guanidin-izotiokyanát (GTC)
- heparín
- dextránsulfát
Metódy izolácie a purifikácie RNA sú založené na rýchlej lýze buniek, ktorá efektívne neutralizuje prítomné nukleázy. Kontaminujúce bielkoviny sa odstraňujú fenolovou extrakciou v kyslom prostredí alebo na silikagélových kolónkach. Zvyšky chromozomálnej DNA je možné rozložiť pôsobením DNázy. Purifikovaná RNA sa využíva na prípravu komplementárnej DNA (cDNA), northernovu hybridizáciu, RT-PCR, alebo na in vitro transláciu. Pri mnohých aplikáciách je výhodné použiť iba frakciu mRNA. Z celkovej ribonukleovej kyseliny sa mRNA najčastejšie purifikuje chromatografiou na oligo-dT nosičoch.
Purifikácia mRNA link
V princípe, izolácia mRNA spočíva vo využití prirodzenej enzymatickej posttranskripčnej modifikácie eukaryotickej mRNA, a to je pridávanie poly(A)-chvostíka na 3'-koniec molekuly mRNA za pomoci enzýmu poly(A)-polymerázy. Oligo-dT nosiče sú jednoduché plôšky, na ktorých sú fixované jednovláknové molekuly so sekvenciou poly(T), a teda sú komplementárne k jednovláknovým mRNA s poly(A) koncami. Ak sa roztok s prítomnými mRNA naleje na tieto nosiče, v prostredí s vyššou iónovou silou (pridanie solí) dochádza k hybridizácii, a teda zachytávaniu mRNA na týchto nosičoch. Následne sa upraví chemické prostredie použitím solí s nižšou iónovou silou a mRNA sa z nosiča oddelí a zozberá do nových skúmaviek, v ktorých je jej koncentrácia podstatne vyššia ako mal pôvodný roztok pred použitou procedúrou.